El transductor lineal es sin duda el más utilizado en reproducción de animales grandes. La principal desventaja de su utilización en la aspiración folicular (OPU), se refiere al limitado espacio entre el transductor y la aguja, lo que impide que todas las regiones del ovario sean puncionadas, incluso para cambiar la posición de los ovarios.
En la actualidad se utiliza el transductor convexo o sectorial, por su versatilidad, facilidad y eficiencia en la fijación y el cambio de posición del ovario, así como una mejor apreciación de folículos pequeños en comparación con el transductor lineal.
La sonda ecográfica para OPU ha sido adaptada para permitir la fijación y manipulación del ovario, de tal manera que este en contacto estrecho con el transductor y a su vez permita que la punta de la aguja pueda visualizarse cuando penetra dentro del folículo a ser aspirado.
Para la aspiración folicular se emplean agujas hipodérmicas desechables de calibre 18 – 19 y 40 – 50 mm de longitud. Las agujas con calibres superiores a 18 están relacionadas con mayores tasas de recuperación, pero con un porcentaje mayor de ovocitos desnudos, así como importantes daños al estroma y una mayor cantidad de sangre en el líquido aspirado. Las agujas de diámetro inferior a 18 han reducido las tasas de recuperación de ovocitos, posiblemente por la lentitud de la aspiración del líquido folicular en el momento de la punción.
Contrario a las expectativas sobre que el bisel corto sería más eficiente, más fácil y rápido de introducir en el interior del folículo, se ha reportado una mayor recuperación y calidad de los ovocitos cuando se utilizaron agujas con bisel largo. La razón sería que el corte del bisel largo permite una superficie más amplia de la punta de la aguja lo que facilita la penetración dentro del folículo y evita la posibilidad de fuga del contenido folicular.
La frecuencia del transductor es una variable importante en el proceso de recolección de ovocitos. Hay citas de 3,5 MHz de frecuencia de 7,5 MHz, 5,0 MHz y 6,5 MHz.

En primer lugar, al iniciar el trabajo, las hembras a utilizar deben sedarse con xilazina y además recibir anestesia epidural con lidocaína al 2% (3-5 ml/vaca). Luego se procede a limpiar y desinfectar la vulva y el periné.

Se introduce el transductor dentro de la vagina, hasta el fornix vaginal, ubicando la cabeza del mismo en el lado del ovario a puncionar. Luego se introduce la mano izquierda por el recto y se retrae el ovario, fijándolo contra la cabeza del transductor.

Luego de ubicar el ovario a aspirar, se impulsa la aguja suavemente para que penetre la pared vaginal y luego la folicular.
Una vez logrado esto la bomba de vacío aspira el contenido y lo deposita en el filtro de embriones o en el recipiente destinado para tal fin. En cualquiera de los casos estos deben contener medio de aspiración heparinizado (PBS+10% de suero fetal bovino).
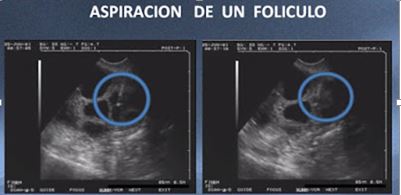
Aspiración de un folículo
En la pantalla del ecógrafo podemos ubicar y visualizar los folículos, así como apreciar la trayectoria de la aguja, la aspiración del contenido folicular, la reducción del espacio ocupado por el folículo y el éxito de la aspiración.

Recolección ovocitos
Luego de completar la aspiración de los folículos en cada uno de los ovarios, los ovocitos son depositados en un recipiente y con posterioridad ser seleccionados para su consecuente maduración.
Selección de ovocitos
El desarrollo in vitro de los ovocitos está íntimamente relacionado con la aptitud que adquieren durante su etapa folicular previa, lo que se denomina maduración ovocitaria. El folículo es una estructura ovárica con dos funciones, producción de hormonas y de ovocitos aptos para ser fecundados. Las mismas son llevadas a cabo por los folículos antrales, los cuales poseen una pared interna de células de la granulosa que se apoyan sobre la membrana basal. Esta matriz extracelular separa las capas epiteliales del mesénquima y afecta la migración celular, proliferación y diferenciación de las células que se apoyan en ella.

La selección de los ovocitos se realiza generalmente con base a tres criterios: el diámetro del ovocito, el aspecto de su citoplasma y las características del cúmulo que los rodea. El diámetro de los ovocitos condiciona su capacidad para madurar de tal forma que los ovocitos bovinos con un diámetro inferior a 110 μm se encuentran todavía en fase de crecimiento y no han adquirido aun la capacidad para madurar.
Los ovocitos rodeados por un cúmulo compacto formado por varias capas de células, presentan mayores porcentajes de maduración, fecundación y desarrollo hasta blastocistos, que los que carecen de cúmulo o los que están rodeados solamente por la corona radiata
Diversos autores han tratado de establecer una relación entre el aspecto del citoplasma y la competencia del ovocito para madurar, ser fecundado y soportar el desarrollo posterior. Así, se ha comprobado que los ovocitos que presentan un ooplasma oscuro muestran una acumulación de lípidos y un buen potencial para el desarrollo, mientras que los que presentan un citoplasma pálido tienen una baja densidad de orgánulos y escaso potencial de desarrollo. Por otra parte, cuando el ooplasma es negro, los ovocitos están envejecidos y tienen un potencial muy bajo para soportar el desarrollo.
El potencial de maduración, fecundación, capacidad de desarrollo embrionario de los ovocitos se puede estimar por la aparición de células del complejo cumulus oophorus (COC), con la siguiente clasificación.
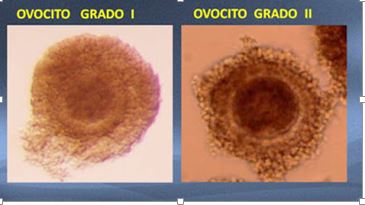
Grado I (GI) – Cumulus compacto, que contiene más de tres capas de células. Ooplasma con granulaciones finas y homogéneas, que llenan el interior de la zona pelúcida y capa de color marrón.
Grado II (GII) – Cumulus compacto que rodea completamente el ovocito, con menos de tres capas de células. Ooplasma con granulaciones distribuidas heterogéneamente, que pueden estar más concentradas en el centro y más claro en la periferia o condensadas en un solo lugar en donde se ve una mancha oscura.

Grado III (GIII) – Ooplasma contraído, con espacio entre la membrana celular y la zona pelúcida, llenando el espacio perivitelino de manera irregular.

Selección de ovocitos
En este grupo se encuentran:
Desnudos: No cubiertos por células del cúmulo o cubiertos en parte por ellas.
Degenerados: Con ooplasma vacuolizado o fragmentado.
Atrésicos: Cumulus oophorus oscuro o con presencia de signos de degeneración
citoplásmica.
Miguel Germán Rivera Gaona – MVZ, Esp. Reproducción











