El proceso de sexaje o semen sexado induce daños en el esperma, debido a la exposición al láser, la alta velocidad dentro del tubo colector, los cambios eléctricos y la temperatura ambiente antes de iniciar el proceso. Considerando que el semen es sometido a una gran variedad de condiciones adversas, es necesario efectuar una evaluación estructural y funcional de estos daños durante el proceso de sexaje, la cual se efectúa por el sistema Casa.
El análisis de la motilidad es una de las características más importantes del semen para el mantenimiento de la fertilidad, por lo que su evaluación tanto subjetiva como por análisis computarizado es esencial en cualquier valoración espermática. Carvalho 2009 encontró una baja velocidad, frecuencia y motilidad lineal, lo cual puede deberse a la exposición al láser, el colorante o los cambios eléctricos.
Además de la motilidad, se han evaluado otros factores como los cambios en el ADN. Varios estudios han demostrado que el sexado no afecta la integridad del ADN espermático debido a la alta cantidad de protamina (histona) presente en el semen bovino.
Otra característica física que puede estar afectada es la integridad de la membrana plasmática. Varios estudios han demostrado que el proceso de sexaje incrementa el porcentaje de membranas plasmáticas lesionadas.
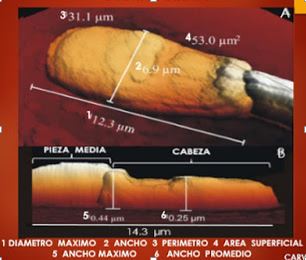
Esta alteración de la membrana va acompañada de cambios en la morfología de la cabeza del espermatozoide. El espermatozoide no sexado presenta una mayor altura, elongación y desigualdad en su superficie, siendo menor su circularidad en comparación con el sexado. Estas modificaciones en conjunto hacen que el espermatozoide disminuya su período de supervivencia en el tracto reproductivo de la hembra.
Aunque varios estudios han evaluado el efecto del proceso de semen sexado en cuanto a sus características estructurales y funcionales, la causa real de la baja fertilidad de este esperma, en especial cuando se emplea in vivo, no ha sido identificada de manera clara, por lo que se considera que esta baja fertilidad tiene causas multifactoriales.
Adicionalmente es importante indicar que el proceso ha mejorado por la introducción de ciertas modificaciones como la disminución de la carga de sexaje y el uso de colorantes para excluir los espermatozoides muertos. Estos cambios hacen el proceso más eficiente y menos lesivo para el esperma.
Por lo general, los cambios en los protocolos FIV, así como la preparación del esperma y el tiempo de coincubación entre el esperma y el ovocito, se han utilizado para incrementar el porcentaje de blastocistos cuando se usa semen sexado. Sin embargo, la tasa reducida de fertilidad después de la IA o tendencias entre las condiciones necesarias para la fertilización, se constituye en un problema para el empleo de semen sexado in vivo. Los resultados asociados a las diferencias entre las condiciones necesarias para fertilización, sugiere que el proceso de sexado compromete los parámetros que, aunque no son importantes en la fertilización in vitro, pueden ser esenciales para le fertilización in vivo.
De otra parte, el tiempo de supervivencia en el tracto reproductivo puede ser lo más notable, ya que el esperma permanece viable después de las 30 horas de la descongelación. En un estudio, Carvalho 2013 mostró que el proceso de sexado tiene un efecto negativo sobre la motilidad, potencial de la membrana mitocondrial y la integridad de la membrana plasmática y acrosomal
Algunos estudios han documentado que el desarrollo del embrión se ve comprometido después de la IA con semen sexado, los que tienden a sustentar esta hipótesis.
El proceso de separación celular lesiona el esperma física y fisiológicamente, lo cual compromete la fertilidad resultante, en comparación con semen procesado convencionalmente, cuando se emplea en IA e IVF.
Citometría de flujo
En la actualidad para el sexado de espermatozoides se emplea principalmente la técnica de citometría de flujo. Por primera vez fue reportada la identificación de los cromosomas X o Y de la población de espermatozides mediante la utilización de la citometría de flujo por Garner et al., 1983; posteriormente fue validada por Johnson et al en 1989, con el nacimiento de una cría de sexo predeterminado. Las últimas investigaciones documentan la capacidad de la citometría de flujo en lograr la producción de un 90% de crías en bovinos. Sin embargo, por su naturaleza invasiva del proceso de separación sexual, produce efectos negativos sobre la viabilidad y calidad del esperma.
Esta técnica se basa en las características propias del ADN espermático y su contenido en los cromosomas. La cadena cromosómica “X” de la hembra, tiene 3.8% más ADN que la cadena “Y” del macho en bovinos, siendo por consiguiente más grande.
Es el espermatozoide el que siempre determinará el sexo de una cría. El caso es que el espermatozoide puede contener o un cromosoma “X” o uno “Y”; por su parte el óvulo siempre poseerá un cromosoma “X”. Por tanto, para que se produzca una hembra (XX), un espermatozoide “X” debe fertilizar el óvulo. Por el contrario, si fuera un espermatozoide con cromosoma “Y” el que lo fertiliza, se producirá un macho (XY). La mitad de los espermatozoides en un eyaculado portan el cromosoma X y la otra mitad el cromosoma Y, por lo tanto en un lote de vacas los nacimientos de crías machos o hembras se distribuye en un 50% de cada sexo.
Esa diferencia hace que las células espermáticas puedan ser separadas de manera que haya predominio de hembras o machos, para ser empleadas en IA, TE o FIV.
La calidad y concentración espermática de los eyaculados son quizás los factores más importantes para obtener una buena separación de las dos poblaciones espermáticas. Así lo demuestran resultados que indican una alta correlación entre la motilidad espermática, la concentración y la separación de las poblaciones en un citómetro de flujo de alta velocidad. Por ende, la separación de espermatozoides X y Y, se lleva a cabo normalmente en eyaculados con más del 50% de espermatozoides con motilidad progresiva y 75% de espermatozoides normales.
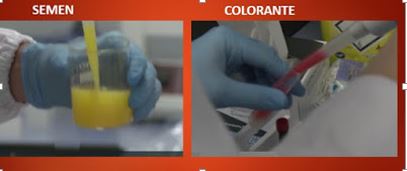
Consiste en la incubación del semen con un colorante (Hoechst 33342), que se adhiere al ADN del espermatozoide produciendo diferentes longitudes de onda, las cuales emiten fluorescencia cuando son sometidos a una luz láser ultravioleta. Como el espermatozoide “X” contiene más ADN, este atrapa más colorante, por lo que es más brillante.

Para poder detectar la diferente fluorescencia y separar los deseados, se utiliza un citómetro de flujo. El mismo consiste en un circuito cerrado de alta velocidad de flujo de líquidos que permite alinear y «leer» los espermatozoides de manera individual en microgotas.
Una vez que el semen entra en el citómetro, es succionado por una bomba de vacío y registrado por diferentes lentes que le dan orientación, previa marcación de las células por el colorante.
– Un cristal piezoeléctrico ondula y quiebra la corriente en gotículas -90,000/segundo.
– Un rayo láser proyecta luz azul sobre los espermatozoides con una longitud de onda específica, de acuerdo al contenido de ADN de la célula.
– Los espermatozoides «X» poseen una fluorescencia 4% mayor que la intensidad de los «Y».
– La computadora procesa la fluorescencia detectada y categoriza los espermatozoides como «X», «Y» o dudosos.
– Se aplica una carga negativa, positiva o ninguna, a las gotículas.
– Las gotículas cargadas son desviadas cuando pasan frente a placas cargadas continuamente. Las de carga positiva son atraídas al lado negativo y las de carga negativa lo son al lado positivo.
– Los espermatozoides seleccionados son recogidos en tres recipientes.
– Conjuntamente se adiciona otro colorante, el Yoduro de Propidio (PI) que permite identificar los espermatozoides muertos o dañados y separarlos sin carga eléctrica de los espermatozoides sexados viables, en un recipiente independiente.
Del total de muestra obtenida en el eyaculado inicial, aproximadamente 20% de los espermatozoides es colectado en la fracción X, 20% en la fracción Y, mientras que el 60% restante lo constituyen espermatozoides que no pudieron ser detectados por la técnica. La dosis de semen sexado contiene en promedio un 90% de espermatozoides del sexo deseado, además de no contener espermatozoides muertos o dañados, pues son separados durante el proceso de sexado.
Una vez separados los espermatozoides, el semen fresco debe utilizarse dentro de las 24 horas siguientes, o son congelados para su utilización posterior.
La diferencia de esta técnica de citometría de flujo con otras técnicas radica en:
- Excelente velocidad (miles de células por segundo, contra el conteo manual)
- Excelente precisión
- Inocuidad con las células sometidas o con materiales biológicos (la viabilidad celular no cambia, ni su función) al ser procesadas por la máquina
- Posibilidad de tomar varios parámetros o medidas de una célula al mismo tiempo
Las características del semen luego del sexado deben estar entre:
- Motilidad progresiva superior al 45%
- Acrosomas intactos a las 3 horas de incubación del 50%
- Recuento de espermatozoides por pajilla 3 x 106
- Menos de 25% de colonias de bacterias por muestra
- Mínimo 87% de selección de sexo
Puesto que por el porcentaje aleatorio de género en pajillas convencionales, se espera un 50% de pérdidas, estas dosis contienen entre 2.5 a 3 millones de espermatozoides por pajilla. Las casas productoras de genética superior aconsejan usar el semen sexado en novillas o vacas superovuladas y/o FIV, para las cuales producen pajillas con concentraciones más altas (5 millones), con buenos resultados de fertilización.
La fertilidad en el ganado bovino está condicionada por diversos factores cuando se utiliza semen sexado, ya que tiene un tiempo de supervivencia menor en el útero que las dosis convencionales, alterando el intervalo óptimo para inseminar el animal en relación con el momento de la ovulación. A su vez, el menor número de espermatozoides de la dosis y la fertilidad asociada a un toro determinado, hace que se reduzca la tasa de concepción de la explotación. En consecuencia, si se tienen en cuenta algunas variables como la expresión o no del celo, el momento de la inseminación adaptado al menor período de vida del semen sexado y el porcentaje de preñez obtenido, se está más cerca de utilizar más ampliamente y de manera programada, el semen sexado.
Miguel Germán Rivera Gaona – MVZ, Esp. Reproducción












