La mortalidad embrionaria ha sido definida por el Comité de Internacional de Nomenclatura Reproductiva como la pérdida del embrión ocurrida entre la fertilización y el periodo final de la diferenciación de estructuras fetales.
En la actualidad se considera que la mortalidad embrionaria en bovinos constituye un problema que causa importantes pérdidas económicas en las industrias ganaderas. Estas pérdidas embrionarias (25 al 40 %) son difíciles de diagnosticar ya que se evidencia que la mayoría de las involucradas retornan a celo a los 20 – 22 días, manifestando un comportamiento estral regular, por lo que se supone que las perdidas embrionarias se originaron entre los días 7 y 17; es decir, el periodo correspondiente entre el transplante embrionario y el reconocimiento materno de la preñez (RMP).
De acuerdo a lo anterior se ha considerado que durante el establecimiento de la preñez se presenta un “periodo crítico” (RMP) muy definido entre los días 15 y 17; se puede decir que la biología reproductiva durante este periodo es multifactorial y compleja, en donde el endométrio podría estar recibiendo una señal antiluteolítica (RMP) no adecuada para ejercer un bloqueo del mecanismo de síntesis y liberación de prostaglandina F2a (PGF2a) endometrial (el mantenimiento de la preñez es dependiente de este bloqueo).
De acuerdo a esto se plantea que las alteraciones en el cuerpo lúteo son las causas más discutidas sobre pérdidas embrionarias o mortalidad embrionaria en bovinos, encontrándose dos tipos de variaciones en la función lútea. La primera consiste en un acortamiento de la vida media del cuerpo lúteo, y la segunda una producción subnormal de progesterona (P4); sin embargo, esta no es la única causa determinante e importante que desencadena en mortalidad embrionaria, ya que factores de otra índole podrían ser igualmente definitivos en los procesos involucrados al respecto.
Pérdidas embrionarias o mortalidad embrionaria
Varios estudios han sugerido la pérdida de un bajo número de embriones inmediatamente después de la fertilización hasta el día 8 de gestación, incrementándose significativamente hasta el día 16 (27 – 31%). Entre el día 16 al 42 disminuye nuevamente el porcentaje de mortalidad alcanzando valores cercanos al 3.8%; adicionalmente 3.1% se presenta entre el día 42 y la parición. Si observamos las cifras, alrededor del 30 % de perdidas embrionarias ocurren después del día 8, es decir al rededor del día que se trasplantan embriones en un programa de transferencia convencional en bovinos.
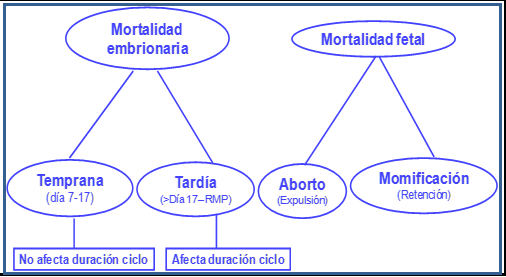
Se deben diferenciar las pérdidas embrionarias o mortalidad embrionaria que ocurren antes del día 17 de la gestación (antes de RMP), de las que suceden después. En el primer caso, la hembra presenta celo en la fecha esperada para este evento fisiológico; en el segundo, la presentación de celo ocurre después del día previsto, lo cual implica que el embrión (o parte del trofoblasto) estaba vivo el día del RMP; esto se presenta porque el cuerpo lúteo continúa secretando P4. En el caso de no existir preñez, o cuando hay mortalidad embrionaria antes del día 17, la PGF2a, actúa sobre el cuerpo lúteo desencadenando la activación de mecanismos luteolíticos.
Desde una perspectiva práctica, la mortalidad embrionaria puede ser monitoreada por diferentes técnicas que determinan progesterona en leche o en suero sanguíneo, Proteína B Específica de la Preñez (PBEP), entre otras.
Los factores causantes de mortalidad embrionaria han sido citados por muchos autores en el siguiente orden:
Factores genéticos
Los embriones pueden ser anormales como resultado de defectos heredados, errores en la meiosis o en la fertilización, por variaciones en el número y estructura cromosómica como es el caso de la poliploidia siendo ésta una de las causas de muerte embrionaria. Hay una extensa lista de citoquinas y factores de crecimiento entre otros sustancias que participan en el proceso de la implantación embrionaria; en referencia a esto último, cualquier anomalía en la expresión génica que resulte en fallas para la síntesis y liberación de moléculas, clave para el desarrollo óptimo del embrión y el éxito de la implantación, podría incluirse entre los factores genéticos.
Una de las posibles causas genéticas de mortalidad embrionaria heredadas por el padre tiene que ver con los errores o fallas en la producción de enzimas, como en la deficiencia de la uridina-5 monofosfato sintetasa, la cual cataliza la conversión del ácido orótico, precursor de la pirimidina, necesaria para la síntesis de ADN y ARN.
La heredabilidad juega un papel importante en la aparición de algunos desórdenes reproductivos en vacas lecheras. Entre ellos se encuentra la retención placentaria, la presencia de locus anormales, endometritis, anestro y ovarios quísticos. La falta de homología entre los cromosomas translocados en el momento de la sinapsis en la profase de la meiosis, afecta la segregación cromosómica, lo cual produce gametos desbalanceados en cuanto a su material genético, por contener duplicaciones o deficiencias que pueden ocasionar mortalidad embrionaria.
La expresión de los genes de la madre mediante el proceso de “imprinting” es vital para el desarrollo embrionario y la supervivencia postnatal. Uno de los mecanismos clave de este proceso es la metilación del ADN, controlado por las enzimas ADN metiltransferasas. Las células germinales sufren reprogramación para asegurar la iniciación del proceso aludido para el normal desarrollo del embrión después de la fertilización. En algunos casos los errores durante el “imprinting” son letales para el embrión, estos conducen a desórdenes durante el desarrollo.
Factores ambientales
El control de la temperatura corporal es un proceso integrado, regulado por mecanismos fisiológicos a nivel del hipotálamo. Los más fuertes efectos del estrés calórico (EC) se observan en ganado lechero, ya que este tipo de bovinos son poco eficientes en mantener la temperatura corporal debido a que la pérdida de calor depende de la evaporación por vía respiratoria y en menor grado por la sudoración como si sucede en ganado tipo carne.
La mortalidad embrionaria se ha visto aumentada en zonas tropicales después de la exposición de la madre a temperaturas ambientales elevadas lo que ocasiona un aumento de la temperatura uterina. Los efectos causados por estrés térmico sobre el embrión joven no son aparentes sino hasta las fases finales de su desarrollo, evidenciándose esto en embriones in vitro sometidos a temperaturas altas, los cuales se afectan pero continúan su desarrollo para posteriormente morir durante la etapa de implantación. En referencia a esto se ha encontrado que los embriones de vacas Bos inducus resisten más estos efectos causados por estrés calórico que los embriones provenientes de madres Bos taurus.
En cuanto a la secreción embrionaria, se ha encontrado que el estrés calórico causado entre los días 8 y 17 de preñez altera el ambiente uterino y reduce en un 72% la secreción de interferon – tau, lo cual repercute negativamente sobre el mantenimiento del cuerpo lúteo y consecuentemente con la viabilidad del embrión (RMP).
Factores nutricionales
La administración de una ración alimenticia que no cumpla con los requerimientos nutricionales de la madre conducen a un balance energético negativo, lo cual trae como consecuencia disminución del peso del animal, baja en los niveles de glucosa sanguínea necesaria para brindar los niveles de energía requeridos para llevar a cabo un desarrollo y mantenimiento fisiológico normal del embrión, así como de las funciones del organismo.
Estudios realizados en la universidad de Cornell han demostrado la reducción en la fertilidad cuando se excede con proteína degradable en el rumen. Esto altera el pH uterino, por lo cual se podría modificar la concentración de los iones, afectando de esta manera la ionización de los sustratos energéticos para el embrión, poniendo en peligro su sobrevivencia antes del reconocimiento materno de la preñez.
Algunos investigadores han explicado que el déficit de energía frente a exceso de proteína altera la correcta actividad de importantes zonas endocrinas. Según esto, se causa alteración de la síntesis y secreción hormonal, conllevando a que los ovarios respondan inadecuadamente lo que desencadena en muerte embrionaria.
Factores tóxicos
Se han establecido una serie de sustancias como los fitoestrógenos entre otras, que podrían llegar a ser consumidas por las vacas, lo cual podría causar alteraciones reproductivas que conlleven a mortalidad embrionaria.
Se presentan han presentado estudios acerca del consumo de plantas del género Astragalus spp y oxytropis spp, en los cuales se ha demostrado que producen malformaciones fetales, modificaciones en el balance de los fluidos fetales, así como muerte fetal y aborto, lo cual se atribuye al contenido de alcaloides pirimidínicos.
Plantas como el pino (pinus ponderosa) causa alteraciones hormonales y modificaciones en el fluido sanguíneo produciendo en determinado caso el ambiente inadecuado para desarrollo y manutención del embrión.

Factores patológicos
Agentes infecciosos como la Leptospira spp, Campylobacter fetus y Trichomona fetus pueden causar muerte embrionaria. De igual manera ocurre con el Haemophilus somnus, el cual también presenta un alto tropismo por los tejidos del sistema reproductivo generando fallas en la fertilización. De la misma forma agentes microorganismos como Mycoplasmas spp. y Ureoplasmas spp., están asociados a desórdenes reproductivos. El Ureoplasma diversum es genera alteraciones en la fertilidad en los bovinos, igualmente se incluye entre los causantes de mortalidad embrionaria.
Los virus son quizás los que más problemas acarrean, ya que afectan la viabilidad de los embriones; tal es el caso del virus de la diarrea viral bovina, que penetra la zona pelúcida y causa la degeneración de los embriones. También los virus de la rinotraqueitis infecciosa (IBR) y el virus de la lengua azul en los bovinos y ovinos son agentes causantes de desórdenes reproductivos.
Factores hormonales y uterinos
El control endocrino para la síntesis de proteínas uterinas durante el desarrollo embrionario temprano ha sido parcialmente aclarado en los bovinos; en tal sentido, se reporta que la P4 es la responsable de los cambios cualitativos y cuantitativos de proteínas en el medio ambiente uterino controlando la síntesis y secreción de por lo menos 10 proteínas. De acuerdo a esto se deduce que deficiencias en esta hormona podría causar que el endometrio llegue a ser deficiente en la producción de los nutrientes necesarios para la sobrevivencia del embrión.
El desequilibrio entre estrógenos y P4 puede causar mortalidad embrionaria ya que estas hormonas interactúan para la inducción de proteínas específicas del útero (CSF- 1, EGF, LIF, IL – 1, Proteinasas, Prostaciclin, Blastoquinina, Calcitonina, Dipetil peptidasa – IV, Glicoproteína CD 44), necesarias para el proceso de implantación y mantenimiento embrionario. Igualmente se plantea que un desequilibrio de estas hormonas altera el mecanismo de transporte del embrión, acelerándolo o volviéndolo lento, lo cual causa muerte de este antes de la implantación.
Factores inmunológicos
Aunque existen numerosos estudios que analizan los mecanismos por los cuales la madre tolera la presencia del embrión (conceptus alogénico), no se ha profundizado suficientemente en los procesos inherentes al rechazo inmunológico, lo cual causa muerte embrionaria. Sin embargo se sabe que el embrión hereda características del padre ajenos a los de la madre receptora (Aloingerto). El donador en este caso el padre o madre y padre en el caso de trasplante embrionario posee antígenos de los que carece el receptor, lo que provoca el rechazo del tejido trasplantado, esto genera la mortalidad embrionaria en determinadas etapas de desarrollo.
El antígeno clase I – Complejo Mayor de Histocompatibilidad (MHC) actúa como presentador de los antígenos del donador lo que permite a los linfocitos reconocer estos antígenos extraños para no destruirlos. Los MHC, inactivan en las capas externas de los trofoblastos placentarios. Una vez formada la placenta ya no se detectan moléculas MHC Clase I, entonces la antigenicidad potencial del feto (Vigilancia inmunológica) se reduce, pero se ha encontrado que otro antígeno el HLA-G previene de manera preferente a los blancos desprovistos de moléculas MHC para que el embrión no sea destruido.
Una vez formada totalmente la placenta brinda un bloqueo para que no sea atacado el aloingerto (embrión), constituyéndose como el medio preferente de protección del individuo en desarrollo.
Es posible que las fallas en los mecanismos de aceptación del conceptus alogénico (embrión), constituyan una causa de mortalidad embrionaria. En el caso de los transplantes embrionarios, es importante tener en cuenta que las vacas receptoras están recibiendo una carga antigénica adicional, proveniente de las madres donadoras.
Factores de otro tipo
Situaciones causantes de estrés podrían desencadenar disturbios en el proceso de implantación y en consecuencia causar mortalidad embrionaria. El período embrionario es la fase más crítica, durante la cual el embrión necesita condiciones óptimas para su sostenimiento, sobre todo cuando realiza la adhesión lenta y gradual a las paredes uterinas. Esta comienza hacia el día 18 de la gestación, y el día 36 aún no se ha realizado en toda la extensión del alantocorion normal, pues existen áreas de membranas embrionarias necrosadas. La implantación se completa en toda la extensión mencionada, después del día 70 de la gestación. Teniendo en cuenta esto se sugiere que el diagnostico reproductivo por medio de palpación rectal no debería hacerse antes de los 60 días de la preñez.
Comentario final
Se concluye que los porcentajes de pérdidas embrionarias son considerables durante los primeros días de desarrollo; la interrelación compleja entre varios factores son los que determinan el establecimiento de la preñez, cualquier falla en uno de los procesos moleculares pueden desencadenar en perdida de la gestación.
Néstor Tovío L.1; Arturo Duica A.2; Henry Grajales L.3
1, 2, 3 Grupo de Investigación en Biología de la Adaptación de los Animales al Trópico, Facultad de Medicina Veterinaria y de Zootecnia, Universidad Nacional de Colombia sede Bogotá. 1, 2 Zootecnista, MSc. (c); Médico Veterinario, MSc. (c), investigadores vinculados DCPA, FMVZ, UNAL sede Bogotá. 3Zootecnista, MSc., PhD. Profesor Asociado DCPA, FMVZ, UNAL sede Bogotá.












