La Leptospirosis o Leptospira es una enfermedad zoonótica con altas tasas de morbimortalidad en humanos y animales causada por una espiroqueta que se encuentra en el medioambiente y una amplia gama de animales (Díaz et al. 2011; Organización Mundial de Sanidad Animal 2008). La bacteria genera trastornos reproductivos en los bovinos y porcinos y está clasificada en subgrupos y serovares determinados por sus funciones antigénicas (Zuluaga 2009).
El género Leptospira está dividido en especies patógenas y saprófitas con 20 genomoespecies, basado en el estudio del gen 16S; a su vez, se han dividido en tres grupos filogenéticos: patógenas, intermedias y saprofíticas, y cada uno de ellos está conformado por diferentes serovares, considerados de importancia para monitoreo diagnóstico y epidemiológico (Fenner et al. 2010; Cerqueira y Picardeau 2009).
En estudios epidemiológicos realizados en el país (Díaz et al. 2011) se examinaron serológicamente 2.140 sueros bovinos del Eje Cafetero y se encontró que 681 muestras (32 %) resultaron positivas al serovar L. hardjo; 390 muestras (18,2 %), al serovar L. icterohaemorrhagiae; 207 muestras (9,6 %) al serovar L. pomona y 182 (8,5 %) al serovar L. canícola.
Evidencias serológicas y aislamientos realizados en el país, indican que L. hardjo tiene importancia epidemiológica en los bovinos de los Llanos Orientales con prevalencias del 63,5 %, en hatos del Valle del Cauca, con el 80,9 % y en la costa Caribe, con el 89,1 %. Así mismo, estudios de las regiones Caribe, Piedemonte Llanero y Andina mostraron prevalencias de Leptospirosis serovar L. hardjo del 32,8 %, 24,8 % y 14,4 %, respectivamente, con un promedio para el país del 21,7 %.
El objetivo de este trabajo fue clasificar aislamientos de campo de Leptospira a través del análisis filogenético y de los ribopatrones basados en el polimorfismo generado por los fragmentos de restricción de longitud polimórfica (RFLP), utilizando como marcador molecular el gen 16S ADNr, con el fin de poder identificar especie, grupo de patogenecidad, serovar y variantes genéticas dentro de estos aislamientos.
Materiales y métodos
Las ecorregiones escogidas para desarrollar el trabajo fueron Valles Interandinos, Costa Caribe y Piedemonte Llanero. Se tomaron 140 muestras de riñón y 20 de orina de bovinos, directamente de vejiga, en cinco mataderos ubicados en Zipaquirá (Cundinamarca), Ibagué-Espinal (Tolima), Guamal (Meta) y Ciénaga de Oro (Córdoba). Así mismo, se obtuvieron 367 muestras de orina por micción espontánea en 11 hatos bovinos ubicados en el Altiplano Cundiboyacense (3), Tolima (2), Córdoba (2), Meta (2) y Casanare (2). Para el trabajo de toma de muestras, se utilizaron dos formatos de toma de información en campo y, para los aislamientos, se implementaron los protocolos de aislamiento de Leptospira a partir de riñón y de orina que hacen parte del Banco de Germoplasma de Microorganismos, Virus y Bacterias de Corpoica, actualmente Agrosavia.
En la planta de sacrificio, se retiró el riñón completo y se transportó sin refrigeración a un sitio de menor contaminación; el área de extracción de la muestra se esterilizó con una espátula caliente y ayuda de una pipeta Pasteur estéril. Se sembró en medio líquido Ellinghausen-McCullough-Johnson-Harris (EMJH) y después de 48 horas de incubación a 30 °C, se tomaron 3 ml del cultivo inicial que fue filtrado a través de un filtro milipore (0,22 μm) a un medio semisólido con 0,1% de agar. La incubación a 30 °C se mantuvo hasta por 90 días, tiempo en el cual se descartó como negativo o se determinó como positivo, al observar la aparición de un anillo en la porción media del tubo, indicativo de crecimiento de Leptospira spp.
El aislamiento de Leptospira spp., a partir de orina recolectada de micción espontánea o directamente de vejiga de animales sacrificados, se realizó pasando
3 ml de la orina a través de un filtro milipore (0,22 μm) y sembrado en medio semisólido Ellinghausen-McCullough-Johnson-Harris (EMJH) con 0,1% de agar a 30 °C. Se revisaron los cultivos cada 8 días para observar el crecimiento y verificar que no existiera contaminación. Si se contaminaban, el cultivo era filtrado con membrana de 0,22mm y llevado nuevamente a incubación a 30 °C, hasta observar o no el crecimiento de Leptospira por un lapso no mayor a 90 días.
Para el análisis filogenético, a los aislamientos se les realizó extracción de ADN por el método de fenol cloroformo, de acuerdo al protocolo Extracción de ADN para bacterias del género Leptospira Código IN-R-104. La amplificación de la región 16S del ADNr fue realizada por PCR (protocolo código IN-R-107), utilizando iniciadores universales externos (Morey et al. 2006; Janda y Abbott 2007).
Los productos de PCR fueron clonados, utilizando un kit comercial TOPO TA 4 Cloning® Kit (Invitrogen) y el ADN plasmídico fue secuenciado. Las secuencias del 16S ADNr fueron alineadas y comparadas con las bases de datos del GenBank, usando el algoritmo Basic Local Alignment Search Tool (BLAST) para la construcción de los árboles filogenéticos. Para la ribotipificación, se utilizó la enzima de restricción EcoRV; este polimorfismo fue evidenciado por Southern Blot, utilizando sondas marcadas, homólogas a secuencias de ADN del gen 16S ADNr y el proceso de detección fue realizado por quimioluminiscencia.
El análisis de la secuencia del gen 16S ADNr de los aislamientos de Leptospira permitió la identificación de especie y clasificarlos dentro de los tres grupos de patogenicidad previamente establecidos: patógeno, saprofito e intermedio. Este análisis se realizó con los siguientes criterios:
• Porcentaje de cubrimiento: por medio del cual se determina el porcentaje de homología entre la secuencia problema y las reportadas en las bases de datos.
• Porcentaje de identidad: por medio del cual se determina el grado de identidad que existe entre la secuencia problema y las reportadas en las bases de datos. Los porcentajes por debajo de 95 % no fueron tenidos en cuenta, puesto que cepas con menor porcentaje de identidad en las secuencias de la región del gen 16S ADNr es improbable que lleguen a estar relacionadas a nivel de especie.
• Valor E (E-Value): por medio del cual se determina la probabilidad de que el resultado obtenido sea el más acertado
Resultados y discusión
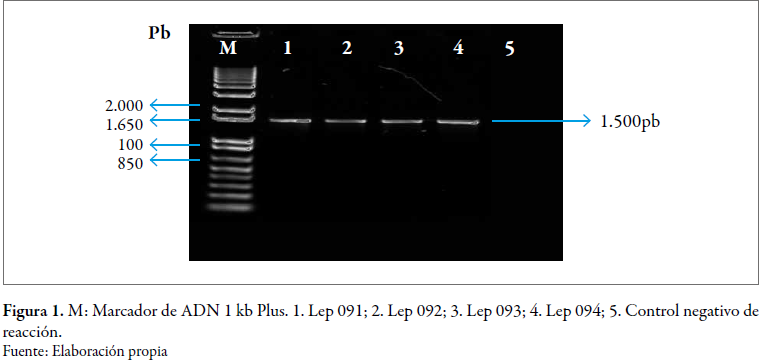
Una vez realizado el seguimiento bacteriológico, se determinaron 69 aislamientos como sospechosos, los cuales fueron sometidos a pruebas de reacción en cadena de la polimerasa (PCR) amplificando el gen 16S del ADNr, para analizar si estas espiroquetas están agrupadas en un ancestro común de protospirocheta, como lo determinan Paster et al. (1991). Se obtuvieron cuatro productos de amplificación de la región del 16S del ADNr (figura 1), que mostraron un fragmento cuyo tamaño fue aproximadamente de 1.500 pb. Así se determinó la presencia de Leptospira spp., en esos aislamientos, lo que confirma la sensibilidad y especificidad de la prueba, de esta manera se concordó con lo obtenido anteriormente por varios investigadores que amplificaron el gen 16S (Grimont y Grimont 1986; Paster et al. 1991; Cerqueira y Picardeau 2009; Torres et al. 2013; Romero-Vivas et al. 2013).
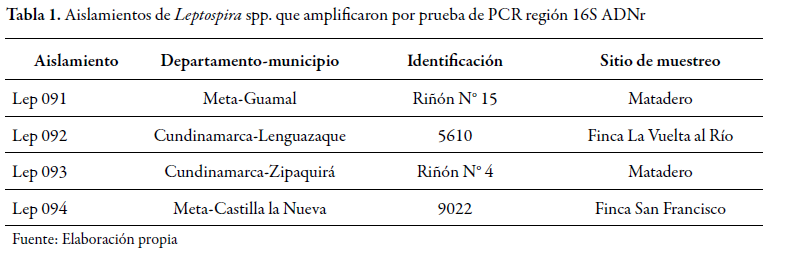
Los asilamientos que amplificaron a Leptospira pertenecían a los departamentos del Meta y Cundinamarca, según se describe en la (tabla 1). Se confirmó que en Colombia, al igual que en otros países como Brasil, India y Nicaragua, existe circulación de cepas de Leptospira spp., en el sistema de producción bovino (Moreno y Agudelo- Flórez 2010). Estos aislamientos de Leptospira en las dos zonas del país, son determinantes para estudios de respuesta inmunológica, dada la característica de patogenicidad de las especies encontradas.
El análisis de secuencia de la región 16S ADNr de los cuatro aislamientos de Leptospira permitió su clasificación en dos grupos de patogenicidad (tabla 2). Según los resultados obtenidos del análisis filogenético de este gen, tres aislamientos fueron agrupados dentro de las especies patógenas y uno se relaciona filogenéticamente dentro del grupo de Leptospiras que presentan una patogenicidad de tipo intermedia; es importante destacar que los árboles filogenéticos de estos aislamientos muestran mayor cercanía con las especies patógenas que con las saprófitas (Postic et al. 2000).
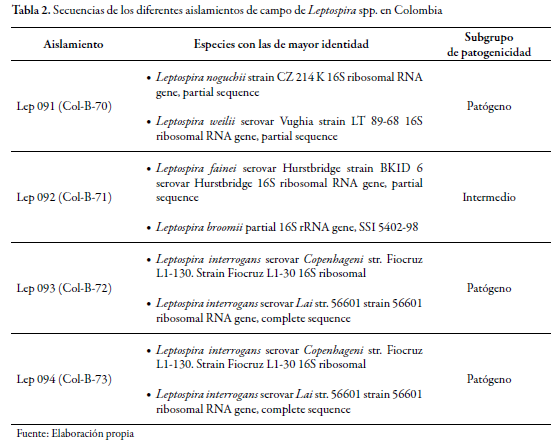
En la ribotificación se obtuvieron ribopatrones de cuatro aislamientos de Leptospira y cinco cepas de referencia con mayor identidad (serovares Vughia, Hurstbridge, Copenhageni y Lai); el análisis de estos ribopatrones mostró la presencia de dos perfiles predominantes dentro de los cuatro aislamientos (tabla 2). Un perfil coincidió con la cepa de referencia intermedio y otro perfil fue similar a la cepa de referencia patógena serovares Copenhageni y Lai. La patogenicidad del aislamiento que, por análisis filogenético fue agrupado dentro de las Leptospiras de tipo intermedia, se encuentra todavía en estudio (Cerqueira y Picardeau 2009, Torres et al. 2013; Moreno y Agudelo-Flórez 2010).
El aislamiento de cepas de carácter intermedio cobra gran importancia, dado que no se sabe el patrón de comportamiento inmunológico ante un huésped, lo que podría generar respuestas variables ante la presencia de este tipo de especies, lo que hace más complejos los estudios epidemiológicos.
Con los resultados obtenidos del análisis de las secuencias del gen 16S ADNr se procedió a construir los árboles filogenéticos que reflejan de forma esquemática (figura 1) el grado de parentesco genético entre las bacterias comparadas utilizando el algoritmo Blast y el método de clústers UPGMA (Unweighted Pair Group Method using Arithmetic averages). El método evidenció mayor parentesco entre los aislamientos Lep093 y Lep094, estando, a su vez, estos dos más alejados de los Lep091 y Lep092, con un porcentaje de cubrimiento en todos los casos del 99 y 100 % (figura 2). El resultado del árbol filogenético de estos aislamientos mostró efectivamente lo que se esperaba: mayor acercamiento de los Lep093 y Lep094, dado que estos tenían mayor afinidad por las especies Leptospira interrogans serovar Copenhageni y Leptospira interrogans serovar Lai, como también mayordistanciamiento del Lep091 que tiene mayorafinidad con la Leptospira noguchii y Leptospira weilii serovar Vughia. El aislamiento del grupo intermedio se encuentra más cercano a los Lep093y Lep094 (L. interrogans), lo que permite inferirque posiblemente su comportamiento ante unhuésped podría ser más hacia patógeno quesaprofítico.
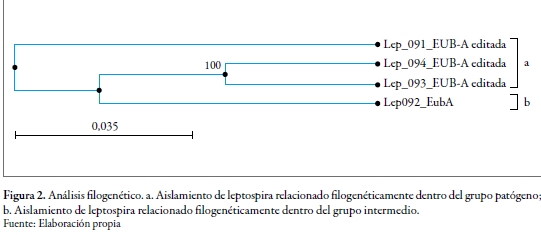
Los análisis filogenéticos de especies de Leptospiras, basados en secuencias comparativas del gen 16SADNr, permiten confirmar lo asegurado previamente (Paster et al. 1991; Schmid et al. 1986; Matthias et al. 2008), sobre la posibilidad de identificar tres grupos basados en el estatus de patogenicidad (patógeno, saprofítico e intermedio), donde el propósito taxonómico de los marcadores genera resultados consistentes en obtener secuencias del gen 16S ADNr, agrupados en un árbol filogenético.
Así mismo, la agrupación de las bacterias por ribotipificación es frecuentemente usada para propósitos taxonómicos y caracterización de subgrupos de microorganismos de diferentes especies de Leptospira (Grimont y Grimont 1986). Lo importante del uso de estas herramientas moleculares es poder clasificar adecuadamente los microorganismos de interés en salud pública con el fin de tomar medidas profilácticas y curativas adecuadas.
Conclusiones
El uso de la ribotipificación de las especies de Leptospira spp., circulantes en el sistema de producción bovino es una herramienta primordial y fundamental para las entidades de control sanitario y para los profesionales clínicos, que manejan el diagnóstico de la Leptospira spp., como causal de problemas reproductivos. El análisis filogenético del gen 16S permitió clasificar los aislamientos dentro de las especies reconocidas hasta el momento y definir su estatus de patogenicidad.
La ribotificación permitió confirmar estos resultados y discriminar variantes genéticas; sin embargo, no se observó heterogeneidad dentro de los aislamientos analizados. Los métodos de análisis filogenético y ribotipificación son complementarios para la identificación de aislamientos patógenos de Leptospira provenientes de diferentes fuentes.
Elizabeth Regina Cassalett-Bustillo,1 Rocío Esperanza Patino-Burbano,2
José Luis Rodriguez-Bautista,3 José Luis Parra-Arango⁴
1. MSc, Universidad Nacional de Colombia. Investigadora máster, Corpoica. Villavicencio, Colombia. .
2 MSc, Pontificia Universidad Javeriana. Investigador máster, Corpoica. Mosquera, Colombia.
3 MSc, Washington State University. Investigador máster, Corpoica. Mosquera, Colombia.
4 MSc, Universidad Nacional de Colombia. Investigador máster, Corpoica, Villavicencio, Colombia.